
您现在的位置是:主页 > 游戏 >
AKG在心血管疾病中的研究进展
2025-03-28 12:21游戏 人已围观
简介结论:AKG对心血管疾病积极意义,AKG调节血脂、改善动脉硬化、改善心肌缺血缺氧、改善心肌肥大、心肌梗死。 心血管疾病 (cardiovascular disease, CVD) 是50岁以上中老年人的常见病,是由心脏和...
结论:AKG对心血管疾病积极意义,AKG调节血脂、改善动脉硬化、改善心肌缺血缺氧、改善心肌肥大、心肌梗死。

心血管疾病 (cardiovascular disease, CVD) 是50岁以上中老年人的常见病,是由心脏和血管发生病 理变化引起的多种疾病的总称,包括冠心病、外周 血管疾病和高血压等,具有高患病率、高致残率和高死亡率的特点,临床上表现为动脉粥样硬化、心肌缺血再灌注(MI/R) 损伤、心肌梗死 (MI)、心肌肥厚、心力衰竭 (HF)、扩张型心肌病、高血压等症状。流行病学统计的结果显示,心血管疾病在全球流行病发病率排名中呈上升趋势,居各种死因首位 。2021年世界卫生组织的统计报告指出,心血管疾病在不同经济体中的死亡率普遍呈上升趋势(中高收入国家、中低收入国家、低收入国家) ;自2000年以来,全球心血管疾病死亡总人数增长了四分之一,仅2019年因心血管疾病而死亡的人数就 已高达1790万人 。
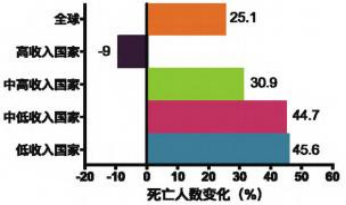
世界卫生组织2021年发布的报告显示,心血管疾病在不同 经济体中的死亡率普遍呈上升趋势(中高收入国家、中低收 入国家、低收入国家);且自2000年以来,全球心血管疾病 死亡总人数增长了四分之一,2019年达到1790万人。
2000−2019年心血管疾病死亡人数的变化(2021世界卫生组织统计报告)
1、AKG含量变化与心血管疾病
1.1 AKG的代谢及氧化应激
作为代谢过程中的关键分子,AKG既作为三羧酸循环的关键中间体参与碳水化合物的代谢过程,同时也作为连接细胞内碳-氮代谢的关键节点 影响氨基酸的代谢。AKG-既可以在α-酮戊二酸脱氢酶的作用下通过脱羧作用生成琥珀酸、水和二氧化碳,最终通过三羧酸循环彻底氧化分解;同时也能在谷氨酸脱氢酶的作用下与氨反应,转化为谷氨酸,并进一步生成谷氨酰胺和谷胱甘肽。
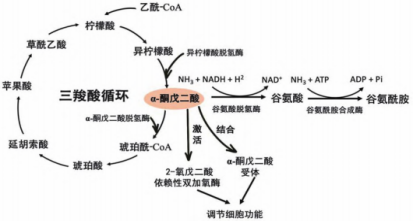
AKG既可以与氨反应,转化为谷氨酸,并进一步生成谷氨酸和谷氨酰胺;也可以通过三羧酸循环生成琥珀酸、水和二氧化 碳。代谢产生的AKG可作用于AKG受体或激活2-氧戊二酸依赖性双加氧酶,进而发挥调节细胞功能的作用。
AKG的代谢过程与感应机制
AKG的感应机制比较复杂,不仅有多种胞浆和细胞核内感应蛋白可以进行特异性识别,也可以通过膜受体发挥作用。2- 氧戊二酸依赖性双加氧酶 (2-OGDDs) 是一组系统发育上保守的酶,可催化各种类型的羟基化反应, 该酶在辅助因子Fe(II)存在时,通过O2和AKG作为共底物发挥作用。在人类中有超过60种 2-OGDDs,它们分别在缺氧反应、脂肪酸代谢、核酸修复和修饰以及表观遗传调控等生理过程中起关键作用。作为OGDDs的必需共底物,AKG对脯氨酰/天冬氨酰/赖氨酰羟基化产生影响,进而调节缺氧诱导因子HIF-1的稳定性和胶原合成。作为G蛋白偶联受体(GPR99/GPR80/OXGR1)的配体,AKG也能通过G蛋白介导的信号通路广泛调节细胞功能。除上述感应机制外,研究人员在向成年秀丽隐杆线虫饲喂AKG的过程中还发现一种新的AKG结合蛋白——ATP合成酶β亚单位,进一步揭示了AKG 所作用的调控网络的复杂性。
作为一种潜在的抗衰老分子和抗氧化剂,AKG能够对抗细胞内氧化还原失衡,预防和治疗 氧化应激引起的各种疾病。早在20世纪90年代,AKG就已凭借其在心肌能量代谢过程中的关键作用,引起了心脏外科手术专家的关注。氧化应激增加是CVD常见的潜在病因之一,活性氧(reactive oxygen species, ROS) 增加不仅会导致一氧化氮可用性降低和血管收缩促进动脉高血压,同时也会导致 心律失常,ROS也会诱发动脉粥样硬化斑块的形成。CVD患者常见血浆游离脂肪酸 (FFA)、胆 固醇或甘油三酯浓度升高,而AKG能够抑制ROS的产生和预防脂质过氧化造成的损伤,降低哺乳动物体内胆固醇、LDL和甘油三酯的含量。 在心血管系统中,线粒体谷氨酸脱氢酶将AKG转化为谷氨酸,谷氨酸对氧化应激有缓解作用,并通过增加三磷酸腺苷 (ATP) 来保护缺血心肌。不仅如此,研究发现在缺血缺氧小鼠体内AKG浓度明显降低。作为心力衰竭的循环代谢标志物,AKG可能在心力衰竭的风险分层、预后评估和治疗指导中发挥特殊作用 ,有望成为临床上心衰诊断和预后评估的标志物。
1.2 心血管疾病中AKG含量的变化
随着年龄的增长,人类血浆中AKG的水平会下降 90%,膳食中补充这种代谢物是恢复其水平的唯一可行方法。衰老过程诱发心血管疾病的发生和发展,AKG 及其代谢过程中相关分子的水平可能与心血管疾病存在相关性。
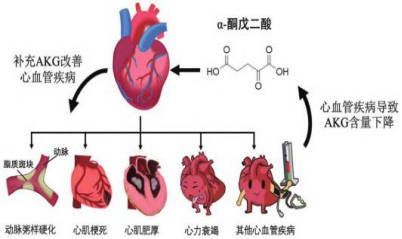
在不同CVD疾病模型中,AKG的含量普遍呈下降趋势,回补AKG可有效逆转这一趋势并改善CVD的发生和发展。
图:AKG含量与CVD之间的关系
Kjellman 等在心脏手术期间发现患者心肌的AKG含量非常低,且心肌中低含量的AKG会加重缺血性损伤。Kouou等的研究指出,缺血/再灌注 (I/R) 损伤影响大鼠心脏谷氨酰胺代谢,具体表现为谷氨酸和AKG含量的下降以及谷氨酸脱氢酶(GDH)活性的降低。I/R损伤组大鼠心肌AKG含量在损伤15 min后下降程度最为显著,提前使用谷氨酰胺预处理则能显著改善I/R大鼠的心脏功能。 在兔心肌缺血模型中,AKG含量在严重缺血时同样呈下降趋势。
心力衰竭的特点是能量需求和供应严重不平衡,心力衰竭发生时心脏ATP的可 用性降低30%~50%并逐渐无法维持心输出量的要求。心力衰竭时,肾素-血管紧张素活性增强,心肌能量代谢异常,心肌能量消耗增加,因此有研究认为血清中的AKG含量可作为心力衰竭的生物标志物。 陈平安的研究发现AKG水平能反映心肌能量消耗水平,因此可以作为评估心肌能量消耗水平的血清标志物。心力衰竭患者的心脏组织中可见由慢性缺氧引起的线粒体异常。Lee 等发现在心力衰竭患者心肌组织分离的线粒体中,以AKG作为底物时的呼吸控制指数明显较低。心力衰竭的发病机制与心肌细胞的代谢重塑密切相关。调节衰竭心脏中的谷氨酰胺代谢过程已成为治疗心力衰竭的新策略,作为一种代谢回补途径,谷氨酰胺在谷丙转氨 酶或谷氨酸脱氢酶的作用下分解为AKG后进入TCA循环。
AMP依赖的蛋白激酶 (AMPK) 与缺氧条件下血管内皮细胞的生成过程有关,其分为AMPK1α和AMPK2α两个表型。研究发现,骨髓细胞特异性敲除AMPK2α的小鼠股动脉结扎后血流恢复受损超过80%。微阵列分析结果显示,AMPK2α敲除小鼠的后肢中促血管生成相关蛋白的表达减弱。血管生成生长因子受缺氧诱导因子(HIF)的调控,AMPK2α通过调节AKG生成影响HIF-1α的羟化过程。缺氧引起的心肌细胞凋亡能减少AKG 的产生,进而可阻止HIF的羟基化和降解。Mühling 等通过超灵敏荧光高效液相色谱法观察到暴露于低压缺氧环境下长达3周的小鼠心室心肌中AKG浓度下降。
线粒体功能障碍在心肌梗死的病理过程中起着重要作用。Punithavathi 等在异丙肾上腺素诱导的大鼠心肌梗死模型中发现,经异丙肾上腺素处理后,大鼠心肌中线粒体脂质过氧化物的累积显著增加,线粒体中异柠檬酸、琥珀酸、苹果酸和AKG的含量显著下降,NADH脱氢酶、细胞色素C氧化酶、琥珀酸脱氢酶、谷胱甘肽过氧化物酶和谷胱甘肽-S-转移酶的活性显著降低。
Watanabe等在探究谷氨酰胺代谢在氧化应激诱导的心肌衰竭中的调节机制时发现,经H2O2刺激后大鼠新生心肌细胞内的谷氨酰胺、谷氨酸和AKG水平显著降低,且同位素示踪结果显示这一过程伴随着谷氨酰胺酶上调。这表明在氧化应激条件下,心肌通过上调谷氨酰胺酶以补偿AKG的损失及其向TCA循环的补充,并通过维持ATP和谷胱甘肽(GSH) 的水平抑制氧化应激从而发挥心脏保 护作用。
由环境因素和生活方式选择引起的表观遗传畸变与心血管疾病的发生密切相关,如高脂饮食可能改变小鼠心脏DNA羟甲基化水平并导致AKG含量下降。Ciccarone等在高脂饮食饲喂8周和16周的小鼠心脏中观察到DNA甲基化/ 羟甲基化修饰水平的改变以及DNA羟化酶Tet酶家族中Tet3的表达上调,此过程伴随Tet的共底物AKG的含量显著下降。
综上所述,作为代谢途径上的关键分子之一,AKG及其代谢过程中产生的相关分子的含量在不同心血管疾病模型中普遍呈下降趋势。
2、AKG调节心血管疾病
2.1 AKG调节血脂
高血脂又称高血脂症,是指血中脂类含量(胆固醇、甘油三酯、磷脂、游离脂肪酸等)超过正常范围的现象,它与心血管疾病的关系十分密切。
AKG参与调节脂质代谢,在降低体重、调节血浆低密度脂蛋白(LDL)和高密度脂蛋白(HDL)相对含量以及降低高胆固醇血症的风险等方面具有一定积极作用。研究指出AKG可通过增强脂肪氧化来防止氧自由基生成和脂质过氧化损伤,从而使脂肪代谢正常化。
肉碱是协助脂肪酸进入线粒体的载体分子,线粒体外的脂质在肉碱脂酰基转移酶的作用下进入线粒体并在线粒体内完成脂肪酸β氧化。有研究指出AKG参与肉碱的形成。降低AKG水平可能会升高乙酰辅酶A的水平,从而导致游离脂肪酸、 三酰甘油、胆固醇和磷脂的积累,补充AKG后脂质积累效应被逆转。Radzki 等 指出,给予实验性高胆固醇血症模型大鼠不同浓度的AKG (分别为0.01 mol/L 和0.1 mol/L) 可降低血清总胆固醇、 LDL和甘油三酯的含量,升高HDL的含量,且AKG治疗组的体重显著低于对照组。这些证据表明AKG可能对降低冠心病风险具有一定临床意义。
目前AKG已被申请专利作为降低血脂的药物,用于治疗或预防脊椎动物,如鸟和人等哺乳动物血浆胆固醇、LDL和甘油三酯的升高并促进生成HDL。
2.2 AKG改善动脉硬化
动脉粥样硬化是一种慢性炎症反应过程,是心血管疾病的主要病理学基础,血管内皮功能障碍和炎症是其发生和发展过程中的关键环节。动脉硬度与心血管危险因素相关,被认为是心血管疾病和衰老生物体死亡率的独立预测因子。研究指出动脉粥样硬化患者和模式动物的血清和血管壁中通常存在过氧化脂质升高的现象,AKG 能够抑制ROS的产生和预防脂质过氧化造成的损伤,并通过增加细胞代谢维持老年动物的血管弹性。
衰老动物弹性蛋白与平滑肌或胶原的比率降低是导致外周动脉硬化和相对阻力增加的原因之一。随着年龄的增长,动脉壁的氧化应激增加,胶原合成过程及弹性蛋白的活性发生改变,最终导致主动脉壁变硬。AKG是脯氨酰-4-水解酶的辅助因子,由脯氨酰-4-水解酶催化形成的4-羟脯氨是胶原三螺旋形成所必需的物质。Niemiec等发现Ca-AKG显著提高谷胱甘肽过氧化物酶活性,降低超氧化物歧化酶活性,并通过增加总胶原蛋白的含量改善血管硬化,证实了AKG对改善衰老动物血管弹性的积极作用。血管硬化与血管壁Ⅰ型和Ⅲ型胶原的异常积聚有关,脯氨酸在胶原合成中起关键作用,AKG诱导了脯氨酸合成。Harrison等指出AKG 通过诱导脯氨酸合成来逆转或防止衰老动物的动脉硬化。
TET2 (ten-eleven-translocation oncogene family member 2) 是一种在进化上高度保守的去甲基化酶,也是一种依赖AKG和Fe2+的双加氧酶,催化5-mC转化为5-甲羟基胞嘧啶 (5-hmC),而DNA甲基化修饰异常与动脉粥样硬化的发生发展密切相关。李荣庆的研究发现,相较于对照组,高脂饲喂的 ApoE-/-小鼠食用添加AKG的饲料后动脉粥样硬化斑块数显著减少,主动脉窦部的胶原纤维含量明显下降。该研究进一步指出,AKG通过TET2上调血管内皮细胞的自噬及自噬流来抑制炎症因子表达,延缓动脉粥样硬化的发生和发展。
2.3 AKG改善心肌缺血缺氧
心肌缺氧(myocardial anoxia)引起心肌供血不足,临床上表现为冠状动脉血流量降低、心肌氧供应不足等症状。体外研究结果显示补充AKG明显缓解缺氧诱导的损伤,而同时补充亮氨酸和 AKG 能显著提高心脏指数,减少外界不良因素对心脏的损伤,促进心脏生长。Tkachenko等评估了AKG对异丙肾上腺素诱导的心肌损伤大鼠的保护作用,结果显示AKG通过减少氧化应激和调节抗氧化系统的活性缓解了大鼠心肌的缺血程度。
临床研究发现高浓度的AKG能够显著改善冠 状动脉手术患者的心肌功能,该保护作用可能与AKG的氧化作用有关。Kjellman等在接受心脏手术的46~78岁男性中发现,心脏停搏期间提供高浓度的AKG减轻了患者术后心脏缺血的迹象,改善了心肌功能,患者血浆中的缺血标志物血浆肌酸激酶同工酶MB(CK-MB) 和肌钙蛋白T显著减少,术后未检测到AKG对血压的不良影响。富含AKG的含血停搏液可以减轻心脏停搏主动脉阻断和早期再灌注时心肌底物代谢的异常 。
心肌梗死是指由动脉内壁中形成斑块导致流向心脏的血流减少和心肌缺氧,最终损伤心肌的一种疾病,是心血管疾病的临床表现之一。Tishkin等在心肌梗死大鼠模型中评估了AKG的抗缺血能力及其对心肌氧化过程的影响,结果发现 AKG具有显著的心脏保护功能,且这一功能与糖酵解和肌酸激酶系统的酶活化过程中的能量转运有关。研究发现高心脏负荷时细胞通过糖酵解补充能量,并生成ATP、细胞溶质NADH及丙酮酸,在这一过程中糖酵解的还原当量通过线粒体AKG与胞浆苹果酸的交换进入线粒体。
Russ等在阻断冠状动脉诱导的Wistar大鼠心肌梗死模型和过氧化氢诱导的鸡心组织氧化模型中,探究了一种由AKG 、5-羟甲基糠醛、N-乙酰-硒-L-蛋氨酸和N-乙酰-L-蛋氨酸几种活性成分组成的多组分溶液在心脏组织中的抗氧化能力,结果发现这种多组分溶液在两种动物模型的心脏组织中均起到缓解氧化应激的作用,并改善冠状动脉闭塞的情况,其中AKG被鉴定为该多组分溶液中的有 效抗氧化成分。经AKG处理后,心脏组织中的氧化应激标记物丙二醛 (MDA)和羰基蛋白(CPs)水平恢复到损伤前水平。事实上,大量实验均已证实了AKG的抗氧化作用。Watanabe等发现二甲基 AKG 可以改善H2O2刺激后的大鼠新生心肌细胞内ATP和GSH的水平,同时抑制氧化应激诱导的细胞凋亡。
心肌缺血时间有限是限制心脏移植的最重要因素之一,主动脉交叉夹会导致缺血再灌流(I/R)损伤,临床上使用停搏液在体外循环期间保护心脏器官功能。组氨酸-色氨酸-AKG溶液(histidine-tryptophan- ketoglutarate solution, HTK 溶液)是先天性心脏手术常用的停搏液。Hachida 等观察了AKG和色氨酸对保存6小时后心功能恢复的影响,结果发现相较于对照组,去除AKG的HTK溶液处理组的血压显著降低、释放酶 (CK-MB)升高 (P < 0.01),但冠脉流量无明显变化;在去除色氨酸的HTK溶液处理组中仅发现血压和冠状动脉血流百分比的显著下降 (P < 0.01)。因此,研究者们推测AKG与色氨酸联合使用对缺血心肌具有更显著的保护作用。临床研究证实HTK溶液具有保护冠状动脉皮下细胞组织、恢复婴幼儿心脏手术中主动脉开放后自动复跳率等功能。Arslan等的研究表明,使用低剂量 HTK进行短时间钳夹手术可以起到与晶体性心脏停搏液一样的心肌保护效果。
2.4 AKG改善心肌肥大
病理性心脏肥大通常由高血压、心脏瓣膜病、心肌梗死和神经激素等压力刺激和疾病诱导。持续的病理性肥大反应会导致心肌收缩功能障碍和心力衰竭。心肌肥厚和充血性心力衰竭患者体内可以观察到糖酵解的增加,增加果糖2,6二磷酸可抑制小鼠模型的心肌肥大。Liang等发现AKG可以抑制苯肾上腺素灌注所致的心肌肥大小鼠心肌细胞中的[3H]-亮氨酸摄取,表现出一定的抗心脏肥大的作用。
An等发现补充 AKG可抑制压力超负荷引起的心肌肥厚及心脏功能障碍,并抑制压力超负荷条件下的心肌纤维化,且对左心室功能无明显不良影响。研究结果显示,连续9周服用含有2%AKG水溶液的小鼠平均心肌细胞横截面积减少 49.11% (P < 0.001),肌球蛋白重链7 (Myh7)、心房利钠因子(Nppa)等心脏肥大标志物的mRNA和蛋白水平均显著降低,AKG抑制了横断主动脉缩窄小鼠心 肌TGF-β1的过度表达。体外实验进一步证明AKG通过降低血管紧张素II (Ang II)诱导的β-MHC和ANP上调来修复Ang II介导的线粒体膜电位损伤,从而减少心肌细胞凋亡。研究发现AKG通过调控PINK1/Parkin 通路促进线粒体自噬相关蛋白的表达量增加,降低ROS水平,表明AKG可能通过增强有丝分裂期间细胞的吞噬功能来清除受损的线粒体DNA,从而减轻压力超负荷下的心肌氧化应激。
事实上,过度自噬介导的致病性细胞重塑是压力超负荷引起的扩张型心肌病的发病机制之一。 Mariño等发现AKG衍生物二甲基α-酮戊二酸(DMKG)可作为一种自噬抑制剂治疗扩张型心肌病。该研究发现,抑制糖酵解、脂肪酸氧化等过程 导致的AcCoA水平降低会诱导自噬,补充AcCoA则会抑制自噬。持续补充 DMKG可以增加细胞溶质中AKG的浓度,升高AcCoA水平,从而调节自噬过程,改善心肌自噬导致的胸主动脉缩窄反应,缓解左心室扩张和心肌收缩性能降低等症状,消除心肌细胞肥大与心肌细胞纤维化,实现防治扩张性心肌病的目的。
AKG的受体氧戊二酸受体1 (OXGR1)是G蛋白偶联受体(GPCR)蛋白家族成员之一,GPCR通常被认为在调节心血管疾病中发挥重要作用。Omede等发现 OXGR1基因敲除的小鼠横向主动脉缩窄导致心肌肥厚显著增加,心脏收缩功能减弱,心脏射血分数显著降低。进一步的研究显示,OXGR1可能与COP9信号体复合物亚单位5 (CSN5)形成复合物,然后在上游调节因子TYK2的作用下抑制STAT3激活,从而调控心肌肥厚;而OXGR1的缺失则导致STAT3过度磷酸化,加重心脏肥大。这一研究揭示了AKG受体OXGR1在调节心脏功能中 的作用。
2.5 AKG在其他心血管疾病中的功能
心脏交替(cardiac alternans)与快速室上心律失常和心源性猝死的发生有关,研究表明肌浆网Ca2+- ATP酶2a (SERCA2a)上调改善代谢抑制诱导的细胞交替。Stary在探究线粒体功能受损对细 胞交替的影响的过程中发现,不论是对照组还是SERCA2a过表达组小鼠,阻断AKG脱氢酶的功能时,交替程度均明显增加。Nelson等的研究认为AKG与亚临床心房功能障碍和心源性栓塞卒中 有关。
心脏祖细胞 (CPCs) 自体移植可以减轻受损心脏的心肌功能障碍。Salabei等评估了谷氨酰 胺对CPC增殖的调控作用,结果发现谷氨酰胺通过转化为AKG促进CPC的增殖作用,并促进TORC1底物p70S6k以及视网膜母细胞瘤蛋白的快速磷酸化,诱导细胞周期蛋白D1和CDK4的表达;补充谷氨酸盐和细胞通透性AKG (DMKG)均增加了细胞耗氧率,DMKG增加了线粒体氧化磷酸化解偶联剂FCCP刺激的呼吸速率,且mTORC1信号触发的AKG是CPC增殖能力的主要决定因素,证实了AKG在CPC细胞增殖过程中的重要作用。
人心肌间充质细胞(CMSCs)在适当的条件下能够重新定向分化为心肌细胞,因此被认为对心脏修复治疗具有可观的前景。Spallotta等通过代谢组学分析发现,糖尿病患者的CMSCs及HFD小鼠整个心脏的细胞内AKG合成减少。外源补充AKG则拯救了心肌间充质细胞的功能并改善其增殖能力。此外,给予外源 AKG补充后,糖尿病患者的CMSCs的线粒体融合数显著增加,功能也明显改善。
Ogiso等在给血压正常的大鼠静脉注射AKG后发现,10 mg/kg的AKG具有一定的降血压作用。
Baĭramkulov等则评估了AKG和琥珀酸对犬缺血心肌的侧支冠状动脉循环 (CCC)的影响,结果发现AKG (6mg/kg冠状动脉内和60 mg/kg 静脉内)对犬 CCC和心肌的收缩活性具有一定的改善作用。静脉注射 AKG (12 mg/kg)和琥珀酸盐 (100 mg/kg)可显著降低结扎引起缺血的心肌中的葡萄糖消耗,证明一定量的AKG和琥珀酸可用于CCC的校正和缺血心肌的能量供应。
氰化物诱导氧化应激,导致神经毒性、脂质过氧化和膜功能障碍,并显著抑制抗氧化功能,如降低SOD活性和GSH水平。AKG是一种有效的氰化物致死拮抗剂,能改善氰化物导致的心血管损伤。AKG还可以还原心肌细胞中的细胞色素C,并保护氰化物损伤模型中心脏和肝脏线粒体中的氧化磷酸化和细胞色素C氧化酶(Cox)的活性。
3、总结与展望
作为生物代谢过程中的重要中间体,AKG和细胞的合成与分解联系密切。针对 AKG的生物学特征,科学家们开发出了AKG的多种功能并将其应用于伤口愈合、心脏保护等多种场合。不仅如此,AKG在肠道、脾胃、肝脏、心脏、眼等组织的相关疾病,甚至癌症的治疗过程中也表现出了一定的应用价值。
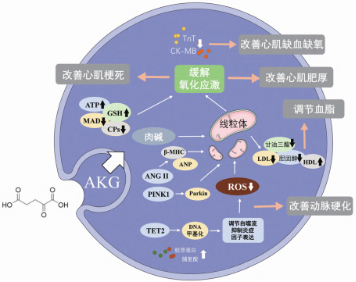
AKG调节心血管疾病的分子机制
AKG还可以调节生物体的衰老过程,延长不同动物的寿命,这为科学家们对 AKG应用的研究提供了新的思路。作为一种极具潜力的膳食补充剂,美国食品药品监督管理(FDA)认为其符合公认安全(generally recognized as safe, GRAS)等级,目前关于AKG在人体中的研究正在开展中。值得一提的是,大多数的人体试验及市面上的配方大多将AKG和氨基酸混合在一起,AKG自身的功效亟待开发。
心脏功能的稳定对生命体的健康发展至关重要。CVD作为全球流行病致死率最高的疾病,如何改善和治疗该疾病是科学家们试图研究和解决的问题。目前治疗 CVD的手段主要包括药物治疗、基因编辑、细胞疗法等。AKG作为生物体自身 细胞新陈代谢过程中产生的重要中间体,相较于其他治疗CVD的药物具有毒性低、副作用小等优点。不仅如此,AKG具有良好的溶解性,在水溶液中相对稳定并可被人体完全代谢。AKG14C标记实验显示,服用该化合物3 h后,肝脏、大脑、皮肤、肌肉和骨组织组织中均已经存在被标记的AKG。大量研究证实,在不同心血管疾病模型中,AKG及其代谢过程中产生的化合物的含量均发生了不同程度的改变,AKG在CVD中扮演的角色还有待进一步探索。研究指出,AKG受体OXGR1可能作为一种调节因子在压力超负荷诱导心肌肥厚中发挥作用,但改变OXGR1的表达是否会影响心肌生长和重塑仍有待研究,OXGR1很可能在未来成为一种新的治疗靶点。
本文就AKG在CVD中的特征及功能进行了综述。AKG通过抗氧化、抗炎、调节免疫系统等方式,保护心肌功能,调节心肌梗死、心肌肥大、心力衰竭等心血管疾病的发生和发展,同时在调节血压血脂、改善动脉硬化等过程中也发挥了一定的积极作用,证实了AKG在治疗心血管疾病方面具有可观的潜在价值,但 AKG保护心血管疾病作用的具体机制研究还较少。值得一提的是,由于肠内 AKG在胃和十二指肠被吸收或代谢,或被胃中的微生物代谢,导致周围组织对 AKG的利用率低,因此如何提高AKG的利用率以及AKG在人体内的营养最佳需要量这一问题也亟待研究。总而言之,作为一种膳食补充剂,可以预见AKG 在预防和治疗心血管疾病方面极具开发潜力。

Tags:
上一篇:旅游小程序——北京琥玥天地
下一篇:欧珀魅影:美妆新势力的宏图展望




