
您现在的位置是:主页 > 教育 >
干货:外泌体的细胞摄取实验报告
2025-09-23 14:47教育 人已围观
简介实验目的: 通过Aco600染料标记外泌体,并与受体细胞共孵育,通过激光共聚焦显微镜观察外泌体被靶细胞的摄取情况。 实验材料: 外泌体红色荧光标记染料Aco600(UmibioUR52423) Exosome是外泌体专...

实验目的:
通过Aco600染料标记外泌体,并与受体细胞共孵育,通过激光共聚焦显微镜观察外泌体被靶细胞的摄取情况。
实验材料:
外泌体红色荧光标记染料Aco600(Umibio UR52423)

Exosome是外泌体专用无血清培养基(Umibio,UR51102)培养的MCF细胞上清液中分离提取获得的高纯度外泌体颗粒,通过超速离心方式获得。(也可直接采购Umibio的成品外泌体)
Aco600-Exosome:24孔板每孔外泌体总颗粒数:1×1010个(5×109-1×1010),外泌体体积100-300ul/孔

实验内容:
1.外泌体荧光标记并去除游离染料
1.1. 用PBS将提取的外泌体浓度调整到约1×1011Particles /mL
1.2. 配制染色孵育体系
1.3. 去除游离染料
l染色完成后,于生物安全柜中加入600μL PBS在样品里,使用100 KDa超滤管,以3000 ×g的离心力离心 5~10 min,进行超滤置换,去除溶液中游离的染料,将上室样品浓缩至原体积
l 重复置换2次
l收集超滤管上室的样本,送检NTA(50μL)、BCA(50μL)
1.
2.共孵育/细胞摄取
2.1.提前24h铺24孔板(先放置细胞爬片),将细胞悬液浓度调整为适当浓度,每孔加入300 μL 细胞悬液,约2×104个细胞
2.2.避光操作:用无血清培养基将染色样本EVs浓度调整为适当浓度
2.3.吸除待处理细胞原有的培养基,用PBS清洗两次
2.4.避光操作:加入300 μL含染色EVs的新鲜培养基,染色EVs的粒子数约为1×1010个/孔,在细胞培养箱避光孵育 24 h
3.细胞染色
3.1. DIO细胞膜染色
l孵育 24 小时后,弃去孵育液,用 PBS 清洗细胞 3 次
l配制所需染色工作液体积
l加入300μL染色工作液,轻轻晃动使染料均匀覆盖所有细胞
l 37℃避光孵育细胞8 min。
l 吸除细胞膜染色工作液,或PBS洗涤3次,每次5min
l使用4%多聚甲醛在室温下固定 10 min后观察细胞形态
l 弃去4%多聚甲醛,用PBS清洗细胞 3 次,每次 5 min
l取出细胞爬片,用含DAPI封片剂进行封片
l 激光共聚焦拍照
3.2. 细胞骨架染色
l孵育 24 小时后,弃去孵育液,用 PBS 清洗细胞 3 次
l使用4%多聚甲醛在室温下固定 15 min后观察细胞形态
l 弃去4%多聚甲醛,用PBS清洗细胞 3 次,每次 5 min
l (不透化)加入0.1% Triton X-100透化5min后用PBS清洗细胞 3 次
l配制所需染色工作液体积
l加入300μL染色工作液,轻轻晃动使染料均匀覆盖所有细胞
l 37℃避光孵育细胞30 min。
l 吸除染色工作液,再用PBS洗涤3次,每次5min
l取出细胞爬片,用含DAPI封片剂进行封片
l 激光共聚焦拍照
实验结果:
外泌体与MCF细胞共孵育24h后的激光共聚焦拍摄结果呈现(细胞骨架染和细胞膜染)
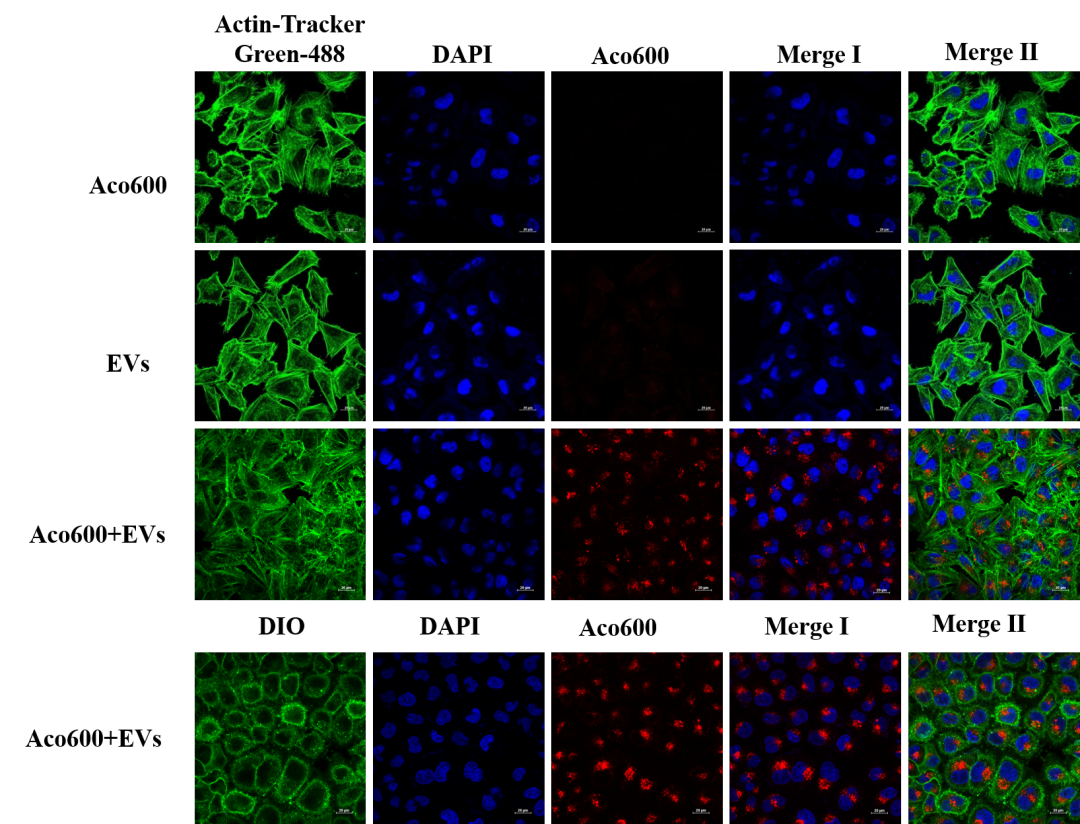
实验分组:Aco600:仅染料组;EVs:仅外泌体组;Aco600+ EVs :外泌体染色组。
相关服务与产品:
Umibio外体研究技术服务
水溶性外泌体荧光标记染料Aco-600,红色
外泌体红色荧光标记染料PKH26
外泌体绿色荧光标记染料PKH67
外泌体专用培养基
外泌体现货-MSC 细胞外泌体(人)
外泌体现货-牛奶外泌体
外泌体超滤管500μL 100kd
实验结论:
1:Aco600游离染料使用100KD的超滤管通过置换的方式可去除干净
2:Aco600可标记外泌体,并能稳定用于激光共聚焦拍摄
3:外泌体与细胞共孵育24h后可被靶细胞摄取,荧光信号较强
扫码关注更多
Tags:




